化学のハテナ
溶液と水溶液の違いは何ですか
水溶液は溶液の一種です。つまり水を溶媒とする溶液だけを「水溶液」といいます。
たとえば、エタノールが溶媒となる場合は「エタノール溶液」というように名称が変わります。
液体に物質が溶けているものは、全て「水溶液」だとは限らないので注意しておきましょう。
溶媒、溶質、溶液の関係を教えてください
簡単に言うと、「溶液」は「溶媒」に「溶質」を溶かしたものです。
下の図では、「溶液」中に「溶質」が浮かんでいますが、実際は形として残らずに溶けています。“溶ける”とは、溶質が目には見えないくらいに小さく分かれ、液中に均一に分散した状態を表します。
たとえば、食塩(溶質)を水(溶媒)に入れた時、はじめは混ざりきらずに白くなり食塩の粒子が残ります。
この状態は目で見える上に透明ではないので、まだ「溶液」ではありません。かき混ぜるなどして、粒子が目で確認できなくなれば、食塩は完全に溶けきったといえます。
このように溶質が完全に溶けなければ、この液体は「溶液」と呼ぶことができないのです。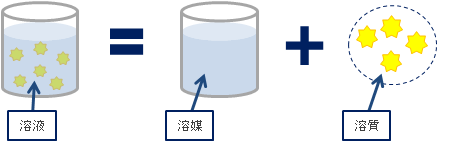
濃度の求め方(計算方法)を教えてください
- 下記は一般的な濃度(質量パーセント)の計算式です。
質量と体積が異なる場合・モル濃度の計算式は異なります。
質量パーセント濃度(%) = 溶質の量(g) ÷ 溶液 [溶媒+溶質] の量(g)×100
例えば、水95gに食塩5gを混ぜた食塩水の濃度は5%となる。
計算式: 食塩5g ÷ 食塩水100g [水95g+食塩5g] × 100 = 濃度5%
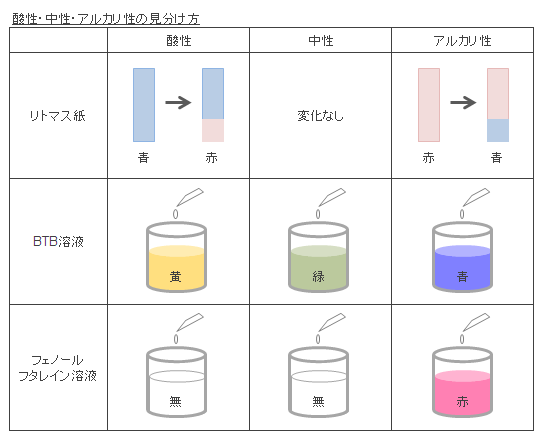
酸性・中性・アルカリ性の見分け方を教えてください
酸性・中性・アルカリ性は「味」で見分けることも不可能ではありませんが、「口にする」という行為は非常に危険なため、安易に行うべきではありません。
見分けるための手段として、見た目の色の変化で判別できる指示薬を使用する方法があり、比較的安全に取り扱えるため、下記のような指示薬が一般的に使われています。
- ≪一般的に使用される指示薬≫
- リトマス紙
- BTB溶液
- フェノールフタレイン溶液
- pH試験紙 ※詳しい使用方法はそれぞれの名称をクリックしていただくとご覧になれます。